Química Geral e Orgânica
1. (Unesp 1989) Uma molécula de hemoglobina, que é uma proteína do sangue, combina-se com quatro moléculas de oxigênio. A massa de 1,00 grama de hemoglobina, reage exatamente com 1,53 mL de oxigênio à temperatura do corpo (37°C) e sob pressão de 760 mm de mercúrio.
Constante universal dos gases = 0,082 atm.L.mol-1.K-1.
a) Calcular o número de moles de oxigênio que se combinou com a hemoglobina.
b) Calcular a massa molecular da hemoglobina.
2. (Unesp 1989) A nicotina contém 73,5% de carbono, 8,6% de hidrogênio e 17,3% de nitrogênio. Sabe-se que este composto contém dois átomos de nitrogênio por molécula. Quais são as fórmulas empírica e molecular da nicotina?
Dados: Massas atômicas: C = 12; H = 1; N = 14
3. (Unesp 1990) Um homem em repouso consome em média 200 cm3 de oxigênio molecular a 27 °C e 1 atmosfera de pressão por quilograma de peso por hora.
O oxigênio consumido é utilizado para produção de energia através da oxidação de glicose, segundo a reação:
C6H12O6 + 6O2 6CO2 + 6H2O
Para um homem de 61,5 quilogramas de peso, calcular:
a) o número de mols de O2 consumido em 1 hora de repouso;
b) a massa de glicose gasta no período de 1 hora.
Massas atômicas: C = 12; H = 1; O = 16
R = 0,082ℓ.atm.mol-1.K-1
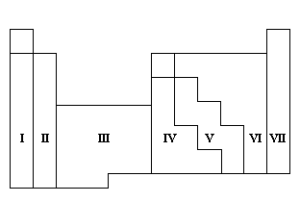
4. (Unesp 1990) Associar os números das regiões da tabela periódica esquematizada a seguir com:
a) os metais alcalinos,
b) os não-metais,
c) os gases nobres,
d) os metais de transição.
5. (Unesp 1990) Um produto comercial empregado na limpeza de esgotos contém pequenos pedaços de alumínio, que reagem com NaOH para produzir bolhas de hidrogênio. A reação que ocorre é expressa pela equação:
2Aℓ + 2NaOH + 2H2O 3H2 + 2NaAℓO2.
Calcular o volume de H2, medido a 0 °C e 1 atmosfera de pressão, que será liberado quando 0,162g de alumínio reagirem totalmente.
Massas atômicas: Aℓ=27; H=1
Volume ocupado por 1 mol do gás a 0 °C e 1 atmosfera=22,4 litros
6. (Unesp 2014) Em sua edição de julho de 2013, a revista Pesquisa FAPESP, sob o título Voo Verde, anuncia que, até 2050, os motores de avião deverão reduzir em 50% a emissão de dióxido de carbono, em relação às emissões consideradas normais em 2005. Embora ainda em fase de pesquisa, um dos caminhos tecnológicos para se atingir essa meta envolve a produção de bioquerosene a partir de caldo de cana-de-açúcar, com a utilização de uma levedura geneticamente modificada. Essas leveduras modificadas atuam no processo de fermentação, mas, ao invés de etanol, produzem a molécula conhecida como farneseno, fórmula molecular C15H24, cuja fórmula estrutural é fornecida a seguir.
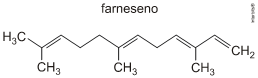
Por hidrogenação total, o farneseno é transformado em farnesano, conhecido como bioquerosene. Nessa reação de hidrogenação, a cadeia carbônica original do farneseno é mantida.
Represente a fórmula estrutural, escreva o nome oficial do farnesano (bioquerosene) e forneça a equação química balanceada que representa a reação para a combustão completa de 1 mol da substância.
7. (Unesp 2012) Organismos vivos destoxificam compostos orgânicos halogenados, obtidos do meio ambiente, através de reações de substituição nucleofílica (SN).
Numa reação de SN, o 2-cloropentano reage com hidróxido de sódio em solução aquosa. O produto orgânico (A) dessa reação sofre oxidação na presença de permanganato de potássio em meio ácido, produzindo o produto orgânico (B). Escreva as equações simplificadas (não balanceadas) das duas reações, o nome do composto (A) e a função química do composto (B).
8. (Unesp 2011) O folheto de um óleo para o corpo informa que o produto é preparado com óleo vegetal de cultivo orgânico e óleos essenciais naturais. O estudo da composição química do óleo vegetal utilizado na fabricação desse produto permitiu identificar um éster do ácido cis,cis-9,12-octadecadienoico como um de seus principais componentes.
Escreva a fórmula estrutural completa do ácido cis,cis-9,12-octadecadienoico e indique como essa substância pode ser obtida a partir do óleo vegetal.
9. (Unesp 2011) Kevlar® é um polímero de condensação com alta resistência ao calor e à tração, sendo empregado na confecção de esquis, coletes à prova de bala, roupas e luvas utilizadas por bombeiros, entre outras aplicações. A intensa atração existente entre as cadeias confere ao polímero propriedades excepcionais de resistência, que têm permitido utilizar cordas do Kevlar® em substituição aos cabos de aço.
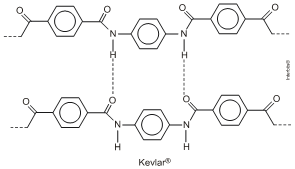
Com base no exposto, qual a função orgânica nitrogenada que compõe a estrutura desse polímero? Dê a fórmula estrutural de seus monômeros e diga que tipo de interação existe entre as cadeias adjacentes.
10. (Unesp 2010) Motores a combustão interna, como os dos automóveis, são atualmente projetados de forma a utilizar diferentes combustíveis, permitindo que se escolha aquele que seja mais vantajoso em cada época. O etanol é muito utilizado no Brasil e a equação para a reação de sua combustão completa é:
2 CH3CH2OH(l) + 6 O2(g) → 4 CO2(g) + 6 H2O(l)
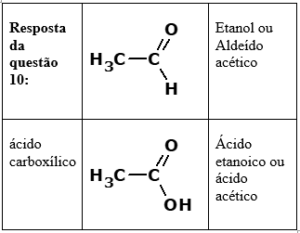
Porém, se o motor não estiver muito bem regulado, a combustão será incompleta, podendo ser gerados outros produtos, dentre os quais duas substâncias – um aldeído e um ácido carboxílico –, ambas contendo dois átomos de carbono em suas estruturas.
Complete a tabela, escrevendo as fórmulas químicas e os nomes dessas duas substâncias.
GABARITO:
Resposta da questão 1:
a) Teremos:
V=1,53mL=1,53×10^(-3) L
P = 760 mmHg
T = 37°C + 273 = 300K
R=0,082×760 mmHg⋅L⋅mol^(-1)⋅K^(-1)
A partir da equação de estado de um gás ideal, vem:
n_(O_2 )=(P×V)/(R×T)=(760×1,53×10^(-3))/(0,082×760×310)=6,0×10^(-5) mol
n_(O_2 )=6,0×10^(-5) mol
b) Teremos:
1 mol de hemoglobina combina com 4 mols de oxigênio
1mol▭ 4mol
n_Hemoglobina=(6,0×10^(-5))/4=1,5×10^(-5) mol
n_Hemoglobina=m/M⇒1,5×10^(-5)=1/M
M=0,666666×10^5 g/mol
M=66667g/mol
MM_Hemoglobina=66667u
Resposta da questão 2:
Fórmula mínima: C5H7N
Fórmula molecular: C10H14N2
Resposta da questão 3:
a) n = 0,5 mol
b) m = 15 g.
Resposta da questão 4:
a) I – alcalinos
b) III – metais de transição
c) VI – não-metais
d) VII – gases nobres
Resposta da questão 5:
0,20 ℓ
Resposta da questão 6:
Hidrogenação total do farneseno:
Combustão completa de 1 mol do farnesano (C_15 H_32):
1C_15 H_32+23O_2→15CO_2+16H_2 O
Resposta da questão 7:
Seguindo “R-L + Nu: “→” R-Nu + L:” , vem:
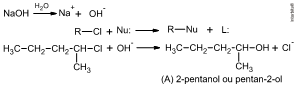
ou
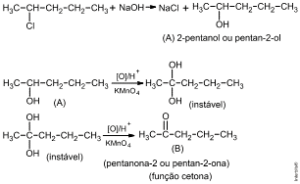
O nome do composto A é 2-pentanol ou pentan-2-ol.
A função química do composto B é cetona.
Resposta da questão 8:
A fórmula estrutural plana completa do ácido cis,cis-9,12-octadecadienoico (H31C17–COOH) pode ser representada por:
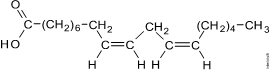
Esta substância pode ser obtida a partir da hidrólise do óleo vegetal:
Óleo vegetal (triéster) + água ® ácido carboxílico de cadeia longa (graxo) + glicerol (glicerina)
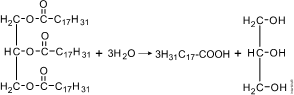
Resposta da questão 9:
A função orgânica que compõe a estrutura desse polímero é a amida:
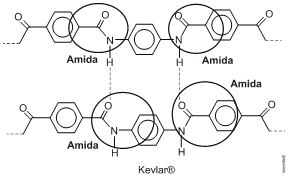
As fórmulas estruturais dos monômeros são:
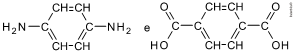
As interações existentes entre as cadeias adjacentes são as pontes ou ligações de hidrogênio.
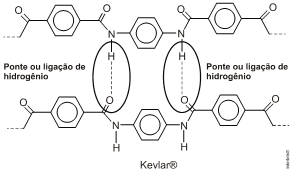
Resposta questão 10: