Química Geral e Orgânica
1. (Unesp 2013) Leia a notícia publicada em janeiro de 2013.
China volta a registrar níveis alarmantes de poluição atmosférica
Névoa voltou a encobrir céu de cidades chinesas, como a capital Pequim.
Governo chinês emitiu alerta à população para os próximos dias.
(g1.globo.com)
O carvão mineral é a principal fonte de poluição do ar na China. Diariamente, o país queima milhões de toneladas de carvão para produzir energia elétrica, aquecer as casas e preparar alimentos. Além do carvão, o aumento do número de carros movidos a gasolina tem papel significativo no agravamento da poluição atmosférica.
Entre as substâncias que poluem o ar da China estão o SO2 e compostos relacionados. Considere as equações seguintes:
(1) “2 S” “O” _2 (g) +” ” “O” _2 (g) ⇄”2 S” “O” _3 (g)
(2) “S” “O” _3 (g) +” ” “H” _2 “O ” (g)⇄” ” “H” _2 “S” “O” _4 (g)
Escreva a equação química que expressa a constante de equilíbrio para a reação (1). Sabendo que uma usina de geração de energia elétrica movida a carvão liberou SO2 suficiente para formar 1 kg de SO3 e considerando a reação (2), calcule a massa de H2SO4, em g, que se forma quando há vapor de água suficiente para reagir completamente com a quantidade de SO3 liberada pela usina.
2. (Unesp 2013) Uma forma de obter hidrogênio no laboratório é mergulhar zinco metálico em uma solução de ácido clorídrico, conforme a reação descrita pela equação apresentada a seguir.
Zn(s)+2HCl(aq)→ZnCl(aq)+H_2 (g)
Considere que uma tira de zinco metálico foi colocada em um recipiente contendo em solução aquosa na concentração de 1 mol/L. Em 20 segundos a temperatura do recipiente elevou-se em 0,05 °C e 25 mL de hidrogênio foram produzidos.
Considerando que essa reação ocorreu a 27 °C e 1 atm, determine a velocidade da reação em mL H2/s e em mol H2/s.
Use: R=0,0″82 L”⋅”atm”⋅〖K^–〗^1⋅”mo” 〖”l” ^–〗^1
3. (Unesp 2012) A imagem mostra uma transformação química que ocorre com formação de precipitado. Foram adicionadas a uma solução de íons (“B” “a” ^(2+) ), contida em um tubo de ensaio, gotas de uma solução que contém íons sulfato (“S” 〖”O” _4〗^(2-) ).
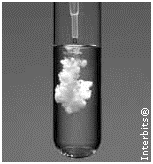
Escreva a equação completa dessa transformação química quando o cloreto de bário e o sulfato de magnésio, devidamente dissolvidos em água, são colocados em contato, e explique se a mesma imagem pode ser utilizada para ilustrar a transformação que ocorre se a solução de cloreto de bário for substituída por “NaO” “H” _((aq) ).
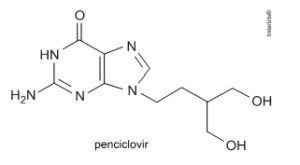
4. (Unesp 2011) Um paciente infectado com vírus de um tipo de herpes toma, a cada 12 horas, 1 comprimido de um medicamento que contém 125 mg do componente ativo penciclovir.
Dados: Massa molar (g.mol–1): H = 1; C = 12; N = 14; O = 16.
Constante de Avogadro: N = 6,02 × 1023 mol–1.
Dê a fórmula molecular e a massa molar do penciclovir e calcule o número de moléculas desse componente que o paciente ingere por dia.
5. (Unesp 2010) A hidrazina (N2H4) e o tetróxido de dinitrogênio (N2O4) formam uma mistura autoignitora que tem sido utilizada em propulsores de foguetes. Os produtos da reação são nitrogênio e água. Forneça a equação química balanceada para essa reação e a estrutura de Lewis para a molécula do reagente redutor.
Dados: Números atômicos: H = 1 N = 7 O = 8
6. (Unesp 2010) As populações de comunidades, cujas moradias foram construídas clandestinamente sobre aterros sanitários desativados, encontram-se em situação de risco, pois podem ocorrer desmoronamentos ou mesmo explosões. Esses locais são propícios ao acúmulo de água durante os períodos de chuva e, sobretudo, ao acúmulo de gás no subsolo. A análise de uma amostra de um gás proveniente de determinado aterro sanitário indicou que o mesmo é constituído apenas por átomos de carbono (massa molar = 12,0 g·mol–1) e de hidrogênio (massa molar = 1,0 g·mol–1) e que sua densidade, a 300 K e 1 atmosfera de pressão, é 0,65 g·L–1. Calcule a massa molar do gás analisado e faça a representação da estrutura de Lewis de sua molécula.
Dado: R = 0,082 L·atm·K–1·mol–1
7. (Unesp 2009) Em 19 de março de 2009, o Presidente da República sancionou a lei que torna obrigatório, a partir de 2014, que todos os veículos de passeio e utilitários esportivos saiam equipados de fábrica com o dispositivo de segurança conhecido como “air bag”. O “air bag” é uma bolsa de náilon fino, com volume de cerca de 80 litros e que, em caso de colisão, é preenchida rapidamente (~40 ms) com N2 O N2 gasoso é proveniente da seguinte sequência de reações:
Sabendo-se que a massa molar do NaN3 é igual a 65 g/mol e considerando-se que, nas condições de reação, (I) 1 mol de NaN3 produz, ao final do processo, 1,6 mol de N2 com 100% de rendimento e (II) 1 mol de N2 gasoso ocupa um volume de, aproximadamente, 25 litros, calcule a massa de NaN3 necessária para produzir 4 (quatro) litros de N2 nessas condições. Apresente seus cálculos.
8. (Unesp 2009) Nos frascos de spray, usavam-se como propelentes compostos orgânicos conhecidos como clorofluorocarbonos. As substâncias mais empregadas eram (Fréon 12) e (Fréon 113). Num depósito abandonado, foi encontrado um cilindro supostamente contendo um destes gases. Identifique qual é o gás, sabendo-se que o cilindro tinha um volume de 10,0 L, a massa do gás era de 85 g e a pressão era de 2,00 atm a 27 °C.
Massas molares em H = 1, C = 12, F = 19,
9. (Unesp 2007) Como o dióxido de carbono, o metano exerce também um efeito estufa na atmosfera. Uma das principais fontes desse gás provém do cultivo de arroz irrigado por inundação. Segundo a Embrapa, estima-se que esse tipo de cultura, no Brasil, seja responsável pela emissão de cerca de 288 Gg (1Gg = 1 × 109 gramas) de metano por ano. Calcule o número de moléculas de metano correspondente.
Massas molares, g . mol-1: H=1 e C=12. Constante de Avogadro = 6,0 × 1023.
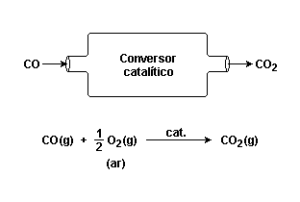
10. (Unesp 2007) O monóxido de carbono é um dos poluentes gasosos gerados pelo funcionamento de motores a gasolina. Segundo relatório recente da Cetesb sobre a qualidade do ar no Estado de São Paulo, nos últimos vinte anos houve uma redução no nível de emissão deste gás de 33,0 g para 0,34 g por quilômetro rodado. Um dos principais fatores que contribuiu para a diminuição da poluição por monóxido de carbono foi a obrigatoriedade de produção de carros equipados com conversores catalíticos.
Responda por que o monóxido de carbono deve ser eliminado e explique quimicamente como atua o conversor catalítico nesse processo.
Gabarito:
Resposta da questão 1:
Equações que podem expressar a constante de equilíbrio:
K=([SO_3 ]^2)/([SO_2 ]^2 [O_2]) ouK_P=〖p^2〗_(SO_3 )/(〖p^2〗_(SO_2 )×p_(O_2 ) )
Estequiometria da reação:
SO_3 (g)+H_2 O(l)→H_2 SO_4 (g)
80g▭ 98g
1000g▭ m_(H_2 SO_4 )
m_(H_2 SO_4 )=1225g
Resposta da questão 2:
Cálculo da velocidade da reação em mL H2/s:
v=(VolumedeH_2 produzido)/tempo=25mL/20s=1,25mL/s
Cálculo da velocidade da reação em mol H2/s:
P×V=n×R×T
1×⏟(25×10^(-3) )┬25mL=n×0,082×⏟300┬(27+273)
n=1,02×10^(-3) mol
v_(H_2 )=(1,02×10^(-3) mol)/20s=5,1×10^(-5) mol/s
Resposta da questão 3:
Equação completa dessa transformação química:
BaCl_2 (aq)+MgSO_4 (aq)→BaSO_4 (s)+MgCl_2 (aq).
Substituindo a solução de cloreto de bário por NaOH(aq):
2NaOH(aq)+MgSO_4 (aq)→Mg(OH)_2 (s)+2NaCl(aq)
■(suspensão@”precipitado”)
Conclusão: A mesma imagem pode ser utilizada, pois em ambos os casos é formado um precipitado branco.
Observação: Na verdade o que ocorre com a substituição do cloreto de bário pelo hidróxido de sódio é a formação de uma suspensão. Mas toma-se “no ensino médio” a expressão precipitado, o que não está totalmente correto. Isto não impede que o aluno responda à questão.
Resposta da questão 4:
A partir da fórmula estrutural teremos:
Fórmula molecular: C10H15O3N5 ou C10H15N5O3
Massa molar = 10 x 12 + 15 x 1 + 3 x 16 + 5 x 14 = 253 g.mol-1
O paciente toma a cada 12 horas um comprimido, logo em um dia toma 2 comprimidos, que equivalem a 2 x 125 mg (250 x 10-3 g).
253 g x 6,02 = 1023 moléculas
250 10-3 g y
y = 5,95 1020 moléculas.
O paciente ingere por dia 5,95 x 1020 moléculas do penciclovir.
Resposta da questão 5:
A equação química será dada por:
2N2H4 + N2O4 3N2 + 4H2O
No N2H4 o número de oxidação do nitrogênio é – 2.
No N2 o número de oxidação do nitrogênio é + 2.
Isto significa que o nitrogênio sofre oxidação, logo o N2H4 é o agente redutor.
A estrutura de Lewis para o N2H4 pode ser representada por:
![]()
Resposta da questão 6:
d=PM/RT⇒M=dRT/P
M=(0,65×0,082×300)/1=16_ g/mol_ (CH_4)
Representação de Lewis:
Resposta da questão 7:
Teremos:
A partir das informações do enunciado (nas condições de reação, (I) 1 mol de NaN3 produz, ao final do processo, 1,6 mol de N2 com 100% de rendimento e (II) 1 mol de N2 gasoso ocupa um volume de, aproximadamente, 25 litros), vem:
1moldeNaN_3 ▭ 1,6moldeN_2
Então,
65gNaN_3 ▭ 1,6×25LdeN_2
m_(NaN_3 ) ▭ 4LdeN_2
m_(NaN_3 )=6,5g
Resposta da questão 8:
O gás pode ser identificado utilizando-se a equação de estado de um gás (PV = nRT).
Temos:
V = 10 L; m = 85 g; P = 2 atm; T = 300 K (27 + 273) e R=0,082 atm⋅L⋅mol^(-1)⋅K^(-1).
Como n = m/M, vem:
P×”V “= m/M×R×T
2×”10″=”85″/M×”0,082″×”300”
M=104,55gmol
104,55 g/mol
Resposta da questão 9:
16 g —– 6 × 1023 moléculas (CH4)
228 × 109 g —– n
n = 1,08 . 1034 moléculas CH4.
Resposta da questão 10:
O monóxido de carbono (CO) surge da combustão incompleta de combustíveis fósseis. Ele deve ser eliminado, pois é um gás tóxico. O monóxido de carbono se liga a hemoglobina formando a carbóxi-hemoglobina provocando uma queda na oxigenação do corpo, o que é altamente prejudicial ao metabolismo humano.
O conversor catalítico, também conhecido erroneamente, como catalisador é um equipamento que transforma o monóxido de carbono (CO) em dióxido de carbono (CO2):
CO + 1/2O2 CO2.