SOLUÇÕES
O que são soluções? Misturas homogêneas de duas ou mais substâncias, nas quais o soluto é o que está disperso e o solvente recebe o nome de dispersante. Solução = Soluto + Solvente.
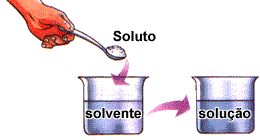
Imagem 1: Ilustração da composição de uma solução.
Em linhas gerais, pode-se dizer que o soluto é a substância que aparece em quantidade menor enquanto o solvente aparece em quantidades maiores.
Classificação das soluções
- Quanto ao estado de agregação da solução: Soluções sólidas, soluções líquidas e soluções gasosas.
- Quanto a proporção entre soluto e solvente: Soluções diluídas contêm maior quantidade de solvente em relação ao soluto (0,5g de açúcar para 2 litros de água) e Soluções concentradas que apresentam muito soluto para uma pequena quantidade de solvente (1000g de açúcar para 0,5 litro de água).
- Quanto à natureza do soluto: Soluções moleculares apresentam moléculas dispersas (moléculas de açúcar C12H22O11 em água) ou então Soluções iônicas possuem íons dispersos (Cl– disperso em água). Nada impede de em uma mesma solução contenha moléculas e íons concomitantemente.
Regras de Solubilidade
Uma substância apolar tende a se dissolver em um solvente apolar, enquanto uma substância polar tende a ser dissolvida por um solvente polar.
MACETE! “Semelhante dissolve semelhante: polar dissolve polar, apolar dissolve apolar.”
O QUE É UMA SOLUÇÃO SATURADA?
Ao adicionarmos uma pequena quantidade de soluto (ex: glicose) a um solvente (ex: água) todo o soluto tende a dissolver-se. Tomamos como exemplo: 5g de glicose em 500 mL de água à temperatura ambiente, toda glicose se dissolve, entretanto se adicionarmos 500g de glicose, parte dela permanecerá não dissolvida; o soluto não dissolvido recebe o nome de corpo de fundo ou precipitado. Uma solução é dita saturada quando o solvente dissolve parte do soluto e outra parte do soluto permanece não dissolvida.
Já a solução insaturada é aquela que contém todo o soluto dissolvido no solvente.
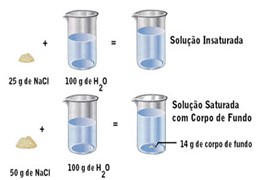
Imagem 2: Ilustração de uma solução insaturada e outra saturada.

Coeficiente ou Grau de Solubilidade é quantidade necessária de um soluto para saturar uma quantidade padrão de solvente em certas condições físicas de temperatura e pressão, por exemplo, o NaCl apresenta um Coeficiente de 357 g/L para água a 0ºC.
Curvas de Solubilidade são gráficos que demonstram uma variação dos coeficientes de solubilidade de determinada substância em função da temperatura.
Referências Bibliográficas
FELTRE, Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005. 700 p.
ATKINS, P.W.; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006. 965 p.
Imagem 1: http://migre.me/v1ByB acesso em 20/09/2016
Imagem 2: http://migre.me/v1O2i acesso em 20/09/2016


