Eletroquímica
1. (Ucs 2016) Centenas de milhares de toneladas de magnésio metálico são produzidas anualmente, em grande parte para a fabricação de ligas leves. De fato, a maior parte do alumínio utilizado hoje em dia contém 5% em massa de magnésio para melhorar suas propriedades mecânicas e torná-lo mais resistente à corrosão. É interessante observar que os minerais que contêm magnésio não são as principais fontes desse elemento. A maior parte do magnésio é obtida a partir da água do mar, na qual os íons Mg^(2+) estão presentes em uma concentração de 0,05 mol/L. Para obter o magnésio metálico, os íons Mg^(2+) da água do mar são inicialmente precipitados sob a forma de hidróxido de magnésio, com uma solução de hidróxido de cálcio. O hidróxido de magnésio é removido desse meio por filtração, sendo finalmente tratado com excesso de uma solução de ácido clorídrico. Após a evaporação do solvente, o sal anidro obtido é fundido e submetido ao processo de eletrólise ígnea.
Considerando as informações do texto acima, assinale a alternativa correta.
a) A filtração é um processo físico que serve para separar misturas homogêneas de um sólido disperso em um líquido ou em um gás.
b) A massa de Mg^(2+) presente em 500 mL de água do mar é de 2,025 g.
c) A eletrólise ígnea do sal anidro produz, além do magnésio metálico, um gás extremamente tóxico e de odor irritante.
d) O hidróxido de magnésio é uma monobase fraca, muito solúvel em água.
e) O processo de eletrólise é um fenômeno físico, em que um ou mais elementos sofrem variações nos seus números de oxidação no transcorrer de uma reação química.
2. (Pucrs 2016) Para responder à questão, analise as informações a seguir.
Em embarcações pequenas com casco de aço, é comum e vantajoso evitar a corrosão pelo método da proteção catódica. Esse método consiste no emprego de placas de metais ou ligas metálicas, as quais, ao serem conectadas eletricamente ao casco, são capazes de gerar uma diferença de potencial suficiente para manterem o metal do casco reduzido. No aço, o principal processo de oxidação pode ser representado por:
Fe_((s))⇄F〖e^(2+)〗_((aq))+2 e^- Eº=+0,44 V
Considerando as informações, a equação associada a um processo adequado de proteção catódica de um casco de aço é:
a) 2〖H^+〗_((aq))+2 e^-⇄H_(2(g)) Eº=0,00 V
b) C〖u^(2+)〗_((aq))+2 e^-⇄Cuº_((s)) Eº=+0,34 V
c) Alº_((s))⇄A〖l^(3+)〗_((aq))+3 e^- Eº=+1,66 V
d) 2 C〖l^-〗_((aq))⇄Cl_(2(g))+2 e^- Eº=-1,36 V
e) Agº_((s))⇄A〖g^+〗_((aq))+e^- Eº=-0,80 V
3. (Ufrgs 2016) O quadro abaixo relaciona algumas semirreações e seus respectivos potenciais padrão de redução, em solução aquosa.
O_3+ 2 H^++ 2 e^-⇄ O_2+ H_2O ε°_red=+2,07 V
H_2 O_2+2H^++2e^-⇄2H_2 O ε°_red=+1,77 V
HClO+H^++e^-⇄1/2 Cl_2+H_2 O ε°_red=+1,63 V
MnO_4^-+8H^++5e^-⇄Mn^(2+)+4H_2 O ε°_red=+1,51 V
A partir desses dados, é correto afirmar que;
a) uma solução aquosa de HClO poderá oxidar os íons Mn^(2+).
b) uma solução aquosa de H_2 O_2 é um forte agente redutor.
c) o ozônio tem uma forte tendência a ceder elétrons em solução aquosa.
d) a adição de H_2 O_2 a uma solução aquosa, contendo oxigênio dissolvido, promove a formação de ozônio gasoso.
e) o permanganato, entre as substâncias relacionadas no quadro, é o mais poderoso agente oxidante.
4. (Pucmg 2016) O potencial padrão de redução de um par redox informa sobre a força oxidante desse par. Considere a tabela abaixo, que relata o comportamento de diferentes eletrodos quando mergulhados em certas soluções.
ELETRODO SOLUÇÃO OBSERVAÇÃO
Zn NiSO_4 Mudança da cor do eletrodo
Pb NiSO_4 Nada aconteceu
Pb CuSO_4 Mudança da cor do eletrodo
Numere a segunda coluna de acordo com a primeira, relacionando o potencial padrão de redução com seu par redox:
1. -0,25 V ( ) Cu/(Cu^(2+) )
2. -0,13 V ( ) Zn/(Zn^(2+) )
3. -0,76 V ( ) Pb/(Pb^(2+) )
4. +0,34 V ( ) Ni/(Ni^(2+) )
Assinale a sequência CORRETA encontrada.
a) 3 – 4 – 2 – 1
b) 4 – 3 – 2 – 1
c) 3 – 4 – 1 – 2
d) 4 – 2 – 1 – 3
5. (Ita 2016) Considere uma célula eletrolítica na forma de um tubo em H, preenchido com solução aquosa de NaNO_3 e tendo eletrodos inertes mergulhados em cada ramo vertical do tubo e conectados a uma fonte externa. Num determinado instante, injeta-se uma solução aquosa de CuCrO4 verde na parte central do ramo horizontal do tubo. Após algum tempo de eletrólise, observa-se uma mancha azul e uma amarela, separadas (em escala) de acordo com o esquema da figura.
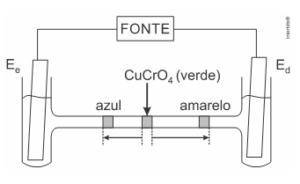
Com base nas informações do enunciado e da figura, assinale a opção ERRADA.
a) O eletrodo E_e corresponde ao anodo.
b) Há liberação de gás no E_d.
c) Há liberação de H_2 no E_e.
d) O íon cromato tem velocidade de migração maior que o íon cobre.
e) O pH da solução em torno do E_d diminui.
6. (Acafe 2016) O cromo é usado na galvanoplastia revestindo estruturas metálicas pelo processo de eletrodeposição. 867 mg de cromo metálico foram depositados sobre um metal em solução ácida que contém óxido de cromo VI sob corrente de 5 A.
CrO_(3(aq))+6 〖H^+〗_((aq))+6 e^-→Cr_((s))+3 H_2 O
Assinale a alternativa que contém o tempo necessário para a realização desse processo.
Dados: 1 F=96.500 C; Cr:52 g/mol; O:16 g/mol.
a) minutos e segundos.
b) minutos e segundos.
c) minutos e segundos.
d) minutos e segundos.
7. (Acafe 2016) Sob condições apropriadas em uma cuba eletrolítica ocorreu a eletrólise de uma solução aquosa de sulfato de cobre II. Nesse processo ocorreu a formação de 6,35 g de cobre e o desprendimento de um gás.
Dados: O=16 g/mol; Cu=63,5 g/mol.
semi reação catódica: C〖u^(2+)〗_((aq))+2e^-→Cu_((s))
semi reação anódica: 2H_2 O_((l))→O_(2(g) )+4e^-+4〖H^+〗_((aq))
O volume do gás produzido quando medido na CNTP é:
a) 2,24 L
b) 1,12 L
c) 6,35 L
d) 3,2 L
8. (Uece 2016) As pilhas de marca-passo precisam ser pequenas, confiáveis e duráveis, evitando algumas cirurgias para sua troca. Como não formam gases, elas podem ser hermeticamente fechadas. Sua duração é de aproximadamente 10 anos. Essas pilhas são formadas por lítio metálico e iodo (LiI). Assinale a alternativa que mostra as semirreações que ocorrem corretamente para formar o produto LiI.
a)cátodo:2Liº→2Li^++2e^-;
ânodo:I_2+2e^-→2I^-.
b)cátodo:2Liº+2e^-→2Li^+;
ânodo:I_2→2I^-+2e^-.
c)ânodo:2Liº→2Li^++2e^-;
cátodo:I_2+2e^-→2I^-.
d)ânodo:2Liº+2e^-→2Li^+;
cátodo:I_2→2I^-+2e^-.
9. (Pucrs 2016) O funcionamento da pilha comumente utilizada em controles remotos de TV, também conhecida como pilha seca ou de Leclanché, é expresso pela equação química a seguir:
Zn_((s))+2MnO_(2(s))+2N〖〖H_4〗^+〗_((aq))→Z〖n^(2+)〗_((aq))+Mn_2 O_(3(s))+2NH_(3(g))+H_2 O_((l))
Um dos motivos de essa pilha não ser recarregável é porque;
a) a reação ocorre em meio ácido.
b) a pilha é lacrada para evitar vazamentos.
c) o processo inverso necessita de muita energia.
d) a massa dos produtos é igual à massa dos reagentes.
e) a amônia sai de dentro da pilha, impossibilitando a reação inversa.
10. (Espcex (Aman) 2016) A energia liberada em uma reação de oxidorredução espontânea pode ser usada para realizar trabalho elétrico. O dispositivo químico montado, pautado nesse conceito, é chamado de célula voltaica, célula galvânica ou pilha. Uma pilha envolvendo alumínio e cobre pode ser montada utilizando como eletrodos metais e soluções das respectivas espécies. As semirreações de redução dessas espécies é mostrada a seguir:
Semirreações de Redução
Alumínio: Al^(3+) (aq)+3 e^-→Al° E°_red=-1,66V
Cobre: Cu^(2+) (aq)+2 e^-→Cu° E°_red=+0,34V
Considerando todos os materiais necessários para a montagem de uma pilha de alumínio e cobre, nas condições-padrão (25 °C e 1 atm) ideais (desprezando-se qualquer efeito dissipativo) e as semirreações de redução fornecidas, a força eletromotriz dessa pilha montada e o agente redutor, respectivamente são:
a) 2,10 V e o cobre.
b) 2,00 V e o alumínio.
c) 1,34 V e o cobre.
d) 1,32 V e o alumínio.
e) 1,00 V e o cobre.
Gabarito:
Resposta da questão 1: [C]
[A] Incorreta. A filtração é um processo físico que separa misturas heterogêneas de um sólido disperso em um líquido ou em um gás.
[B] Incorreta.
0,05 mol de Mg^(+2) ▭( ) 1 L
” “ x ▭( ) 500mL
x=0,025mol
1 mol de Mg^(+2) ▭( ) 24g
” ” 0,025 mol ▭( ) y
y=0,6g
[C] Correta. A eletrólise ígnea irá formar o metal magnésio e o gás cloro (tóxico e de odor irritante), devido à formação do sal cloreto de magnésio, como citado no texto.
Mg(OH)_2+2HCl→MgCl_2+2H_2 O
A eletrólise ígnea será dada primeiro pela fusão do sal, que irá separar os íons, em seguida, esses íons irão se depositar nos eletrodos, conforme as reações a seguir:
Reações da eletrólise ígnea:
MgCl_(2(aq)) →┬( Δ ) ” M” “g” _((aq))^(+2)+Cl_((aq))^-
“cátodo: M” “g” _((aq))^(+2)+▭2 e^-→Mg_((s))^0
ânodo: 2Cl_((aq))^-→Cl_(2(s))^0+▭2 e^-
“M” “g” _((aq))^(+2)+2Cl_((aq))^-→Cl_(2(g))^0+Mg_((s))^0
[D] Incorreta. O hidróxido de magnésio é uma dibase, muito pouco solúvel em água.
[E] Incorreta. O processo de eletrólise é um fenômeno químico, em que um ou mais elementos sofrem variações nos seus números de oxidação no transcorrer de uma reação química.
Resposta da questão 2:
[C]
Considerando as informações, a equação associada a um processo adequado de proteção catódica de um casco de aço deve apresentar maior potencial de oxidação do que o ferro sólido: Alº_((s))⇄A〖l^(3+)〗_((aq))+3 e^-; Eº=+1,66 V.
Resposta da questão 3:
[A]
Uma solução aquosa de HClO poderá oxidar os íons Mn^(2+), pois apresenta maior potencial de redução:
HClO+H^++e^-⇄1/2 Cl_2+H_2 Oε°_red=+1,63 V
MnO_4^-+8H^++5e^-⇄Mn^(2+)+4H_2 Oε°_red=+1,51 V
+1,63 V>+1,51 V
(&5HClO+▭(5H^+ )+▭(5e^- )⇄5/2 Cl_2+▭(⏞5┴1 ) H_2 O@&Mn^(2+)+▭(4H_2 O)⇄MnO_4^-+▭(⏞8┴3 ) H^++▭(5e^- ))/(5HClO+Mn^(2+) →┴( Global ) 5/2 Cl_2+H_2 O+MnO_4^-+3H^+ )
├ (&Mn^(2+) (Nox_Mn=+2)@&MnO_4^- (Nox_Mn=+7))}oxidação
Uma solução aquosa de é um forte agente oxidante.
H_2 O_2+2H^++2e^-⇄2H_2 Oε°_red=+1,77 V
(+1,77 V>1,63V>1,51V)
O ozônio tem uma forte tendência a receber elétrons em solução aquosa, ou seja, apresenta o potencial de redução mais elevado do quadro.
O_3+ 2 H^++ 2 e^-⇄ O_2+ H_2O ε°_red=+2,07 V
A adição de H_2 O_2 a uma solução aquosa, contendo oxigênio dissolvido, não promove a formação de ozônio gasoso:
O permanganato (MnO_4^-), entre as substâncias relacionadas no quadro, é o pior agente oxidante, pois apresenta o menor potencial de redução.
MnO_4^-+8H^++5e^-⇄Mn^(2+)+4H_2 Oε°_red=+1,51 V
Resposta da questão 4:
[B]
A partir da análise da tabela fornecida no enunciado, vem:
ELETRODO SOLUÇÃO OBSERVAÇÃO MOTIVO
Zn NiSO_4 Mudança da cor do eletrodo Depósito de níquel metálico.
N〖i^(2+)〗_((aq))+2e^-→Ni_((s))
(potencial de redução do níquel é maior do que o do zinco)
Pb NiSO_4 Nada aconteceu (potencial de redução do chumbo é maior do que o do níquel)
Pb CuSO_4 Mudança da cor do eletrodo Depósito de cobre metálico.
C〖u^(2+)〗_((aq))+2e^-→Cu_((s))
(potencial de redução do cobre é maior do que o do chumbo)
Conclusão: ε_Cu^o>ε_Pb^o>ε_Ni^o>ε_Zn^o.
Resposta da questão 5: [A]
[A] Errada. O eletrodo E_e corresponde ao cátodo.
A mancha azul é gerada pelo cátion cobre (Cu^(2+)) que migra para E_e.
Isto significa que E_e é o polo negativo (a polarização é gerada pela fonte) da célula, ou seja, região onde ocorre a redução e consequentemente o cátodo.
[B] Correta. Há liberação de gás oxigênio no eletrodo E_d: H_2 O→┴( Oxidação ) 2e^-+2H^++1/2 O_2.
Outra abordagem: o ânion migra para o polo positivo (E_d): 2OH^-→2e^-+H_2 O+1/2 O_2.
Ocorre liberação de gás oxigênio.
[C] Correta. Há liberação de gás H_2 no E_e, além da formação predominante de cobre metálico: 2H_2 O+2e^- →┴( Red ução ) 2OH^-+H_2.
Outra abordagem: o cátion migra para o polo negativo (E_e): 2H^++2e^-→H_2.
Ocorre liberação de gás hidrogênio.
[D] Correta. O íon cromato tem velocidade de migração maior que o íon cobre.
De acordo com a figura fornecida, a distância percorrida pelo íon cromato (CrO_4^(2-)) é maior do que a distância percorrida pelo cátion cobre (Cu^(2+)) num mesmo intervalo de tempo, conclui-se que a velocidade de migração do íon cromato é maior do que a velocidade de migração do cátion cobre.
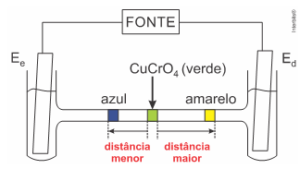
[E] Correta. O pH da solução em torno do E_d diminui, pois ocorre a formação de cátions H^+: H_2 O→┴( Oxidação ) 2e^-+2H^++1/2 O_2.
Resposta da questão 6:
[D]
Q=i×t=5×t
CrO_(3(aq))+6〖H^+〗_((aq))+6e^-→Cr_((s))+3H_2 O
Cr^(6+)+6e^- →┴( ) Cr
6×96.500 C ▭ 52 g
5×t ▭ 867×10^(-3) g
t=1.930,742308 s
t=1.930,742308/60=32,17903846 min
0,17903846 min= 10,7423076 s
t≈32 minu tos e 10 segundos
Resposta da questão 7:
[B]
(&2C〖u^(2+)〗_((aq))+▭(4e^- )→2Cu_((s)) (redução;cátodo)
@&2H_2 O_((l))→O_(2(g) )+▭(4e^- )+4〖H^+〗_((aq)) (oxidação;ânodo))/(&2C〖u^(2+)〗_((aq))+2H_2 O_((l)) →┴( Global ) 2Cu_((s))+O_(2(g) )+4〖H^+〗_((aq))@&2×63,5g▭ 22,4L@&6,35g▭ V_(O_2 )@&V_(O_2 )=1,12L)
Resposta da questão 8:
[C]
Lil é formado por Li^+ e I^-, então:
I_2+2e^-→2I^- (redução)
2Li^0→2Li^++2e^- (oxidação)
Resposta da questão 9:
[E]
A reação que ocorre na pilha seca libera gás amônia e a reação não é reversível nas condições padrão.
Resposta da questão 10:
[B]
Al^(3+) (aq)+3 e^-→Al°E°_red=-1,66V
Cu^(2+) (aq)+2 e^-→Cu°E°_red=+0,34V
+0,34V>-1,66V
ΔE=E_maior-E_menor=+0,34-(-1,66)=+2,00V
Então:
Al°→Al^(3+) (aq)+3 e^- (×2)
Cu^(2+) (aq)+2 e^-→Cu°(×3)
(&2Al→2Al^(3+) (aq)+▭(6 e^- )(oxidação-ânodo)@&3Cu^(2+) (aq)+▭(6 e^- )→3Cu°(redução-cátodo))/(2 (Al°)┬redutor+3Cu^(2+) (aq)→┴( Global ) 2Al^(3+) (aq)+3Cu°


